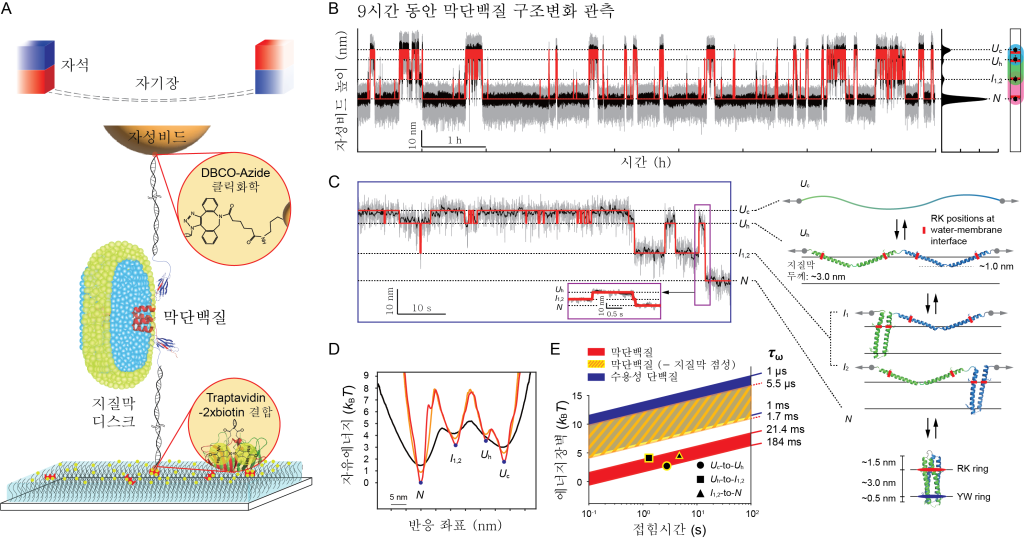
세포막 또는 세포 소기관의 막에 존재하는 단백질인 막단백질(membrane protein)은 세포간 신호전달, 면역반응 등에 관여하는 중요한 단백질 군이다. 시판되는 약물의 약 60% 정도가 막단백질을 표적으로 할 정도로 막단백질의 구조와 구조 형성(접힘, folding)의 원리를 이해하는 것은 의약학적으로 중요하다.
UNIST(총장 이용훈) 화학과 민두영 교수팀은 막단백질이 구조를 형성하는데 걸리는 최소 시간인 “제한속도” 를 최초로 측정했다. 여러 연구를 통해 일반적인 수용성 단백질은 최대 1마이크로초(μs, 100만분의 1초) 정도의 제한속도를 갖는다고 알려져 있지만, 막단백질 접힘의 제한속도에 대해선 알려진 바가 없었다.
특히 접힘의 제한속도를 측정하기 위해선 막단백질의 구조가 빠르게 변화하는 전이(transition) 순간을 포착할 수 있어야 한다. 하지만 막단백질의 전이 현상은 매우 드물게 일어나고, 수십 피코뉴턴(pN, 1조분의 1뉴턴)의 작은 힘에서도 측정시스템이 쉽게 망가져 변화를 측정하기 어려웠다.
연구팀은 이러한 문제를 해결하기 위해 막단백질이 접히고 풀리는 구조 변화를 긴 시간 동안 관측할 수 있는 “튼튼한” 단일분자집게(single-molecule tweezers)를 개발했다. 개발된 단일분자집게를 활용해 12pN의 힘에서 9시간 동안 막단백질의 전이 현상을 관찰했다. 이렇게 최대 1,000번이 넘는 전이 발생의 순간을 포착해 다량의 데이터를 확보할 수 있었다.
연구팀은 관찰된 다량의 데이터를 통해 막단백질 구성의 최소단위인 나선헤어핀(helical hairpin)의 제한속도를 측정했다. 막단백질을 구성하는 나선헤어핀은 나선형 구조 2개가 헤어핀 형태로 결합돼 있는데, 이번 연구를 통해 접힘의 제한속도가 약 20ms(1천분의 1초) 임을 확인했다.
연구 결과 막단백질 접힘의 제한속도는 수용성 단백질에 비해 최대 2만 배 느린 속도이며, 이렇게 느린 속도는 단백질 응집(aggregation) 현상에 치명적일 수 있다는 결론을 도출했다. 또한 연구팀은 지질막의 점성이 나선형 구조 사이의 상호작용을 방해하기 때문에 이런 결과가 나타난다는 의견을 제시했다.
민두영 화학과 교수는 “보통 화학변화 또는 구조변화의 전이 순간과 관련된 제한속도는 측정하기가 쉽지 않지만, 이번 연구를 통해 막단백질 접힘의 제한속도를 최초로 규명했다”며 “본 연구결과는 막단백질 접힘 더 나아가 막단백질의 상호작용에 의미있는 통찰을 제공하며, 막단백질을 표적으로 하는 약물개발에 중요한 기초 지식으로 활용될 수 있을 것”이라고 전했다.
연구 결과는 생명과학분야 저명 학술지인 eLife에 5월 30일자로 온라인 게재됐다. 연구 수행은 과학기술정보통신부 한국연구재단 및 울산과학기술원의 지원을 받아 이뤄졌다.