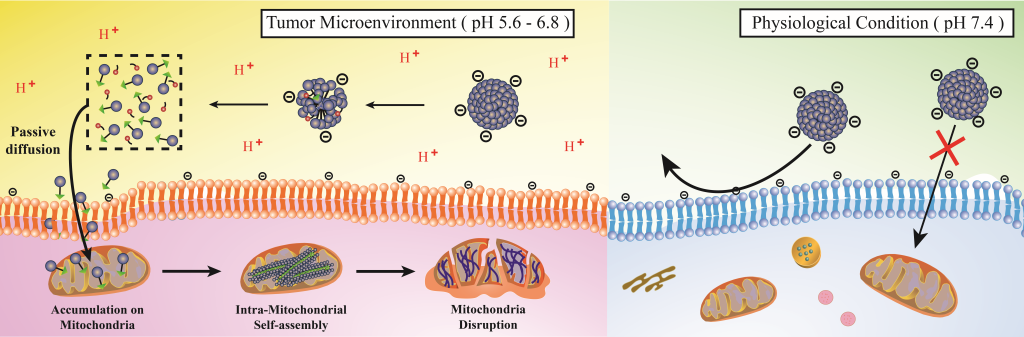
암세포로 이뤄진 종양은 약산성(pH 5.6~6.8)을 띤다. 이 특성을 이용해 암세포를 사멸시킬 수 있는 항암 치료물질이 개발됐다. 이 물질은 종양 환경에서 끊어져 암세포로 침투한 뒤 미토콘드리아의 기능장애를 일으켜 암세포만 골라 죽인다.
유자형 화학과 교수팀은 종양 미세환경에만 감응하는 물질을 개발해, 항암 치료에 사용하는 새로운 기술을 발표했다. 새로 개발한 물질은 암세포 내 에너지 공급원인 ‘미토콘드리아’를 망가트리는 효과적 수단으로 주목받고 있다. 인체 내에서 안정적인 구조로 있다가 종양을 만나면 끊어져 암세포 속으로 들어가기 때문에 표적 능력이 높아지기 때문이다.
새로 개발한 물질은 자기조립을 통해 ‘마이셀(Micelle) 구조’를 이룬다. 마이셀 구조는 안쪽에 기름과 친한 부분을 품고 바깥쪽에 물과 친한 부분으로 둘러싸인 공 모양을 말한다. 이런 마이셀 구조는 생체 내 환경에서 안정적이라 다른 세포를 해치지 않고 이동할 수 있다.
마이셀 구조로 생체 내부를 이동하던 분자가 종양 주변에 도달하면, 산성 환경에 영향을 받은 ‘석시닉 아미드(succinic amide) 분자’가 끊어진다. 이때 마이셀 구조가 무너지며 단분자 형태로 변환되고, 암세포 내 미토콘드리아로 침투한다. 미토콘드리아 속으로 들어간 분자는 다시 자기조립을 진행하면서 미토콘드리아의 막을 훼손한다. 이 때문에 미토콘드리아의 기능장애가 일어나고 결국 암세포는 사멸한다.
제1저자인 진성언 화학과 석‧박사통합과정 연구원은 “정상세포 주변은 pH 7.4 정도의 중성이지만, 암세포로 이뤄진 종양 주변은 pH 5.6~6.8로 약산성이라는 점에 주목해 기존 미토콘드리아 표적 물질에 추가적인 기능을 더했다”며 “산성 환경에서 끊어질 수 있는 분자를 결합한 미토콘드리아 표적 물질은 실제 실험 쥐를 이용한 실험에서도 암세포 사멸 효과가 높았다”고 설명했다.
새로 개발한 물질은 기존 미토콘드리아 표적 항암 물질의 단점을 보완하고, 표적 능력을 높였다는 점에서 차별화된다. 기존 물질은 단분자로 존재해 생체 내에서 오래 머물지 못했는데, 이 부분을 마이셀 구조로 해결한 것이다. 또 종양에 도달했을 때만 단분자 형태로 변환돼 암세포의 미토콘드리아를 파괴하면서 암세포 표적능력을 높였다.
유자형 교수는 “종양 미세환경에만 감응하는 물질의 개발로 암세포에 대한 표적 치료가 가능한 효과적 항암 전략의 개발이 가능하다”며 “향후 약산성 환경 기반 약물 치료제 개발의 새로운 플랫폼이 될 것”이라고 기대했다.
이번 연구는 고려대의 곽상규 화학생명공학과 교수팀과 김세훈 KU-KIST 융합대학원 교수팀이 공동으로 진행했다. 연구결과는 어드밴스드 펑셔널 머티리얼스(Advanced Functional Materials)에 10월 3일(월)자로 게재됐다.